Alzheimerova nemoc, nebo spíše Alzheimerova-Fischerova nemoc?
Každé 3 sekundy se na světě objeví nový případ syndromu demence podle údajů Mezinárodní organizace pro Alzheimerovu nemoc (Alzheimer´s Disease International). V nadpoloviční většině případů (60 %) je to Alzheimerova nemoc, která syndrom demence způsobí, tedy onemocnění typicky spjaté se stářím. V souvislosti se stárnutím populace lze bohužel předpokládat, že nemocných bude v dalších letech stále přibývat a již nyní nemilosrdný interval 3 sekund se bude postupně zkracovat. Alzheimerova nemoc je však chorobou, která ze své podstaty nepostihuje pouze nemocné a jejich nejbližší. Vzhledem k charakteru péče i výši nákladů na ni má i celospolečenské důsledky.
Obecná charakteristika
Do života člověka se vkrádá zprvu zcela nepozorovaně. Patologické procesy v mozku probíhají řadu let až desetiletí před rozvojem prvních říznaků, projeví se však až ve chvíli, kdy způsobí výraznější narušení a odumření specifických oblastí mozku. Jako jedna z prvních bývá zasažen tzv. hipokampus, struktura svým tvarem připomínající mořského koníka, uložená v hloubce spánkového laloku a zodpovídající za formování a uchování nových vzpomínek na události a prostorovou mapu prostředí. Právě z toho důvodu nemocný jako první pociťuje obtíže zapamatovat si nové informace, vybavit plány dalšího dne, stojí ho více sil zorientovat se v novém prostředí. Ruku v ruce s tím, jak se nemoc v mozku vytrvale šíří a ničí fungování dalších mozkových struktur, přidávají se obtíže s orientací v čase a dalšími kognitivními (rozumějme poznávacími) funkcemi. V poslední fázi je mozková tkáň zasažena zcela a kognitivní porucha je natolik hluboká a rozsáhlá, že nemocný pozbývá schopnost samostatně si zajistit základní potřeby. Svět se pro něho stává nesrozumitelným a nebezpečným místem, může mít obtíže srozumitelně sdělit své potřeby. Tyto změny mohou být jedním ze zdrojů depresivních prožitků, úzkostných stavů, v některých případech i nastraženosti, podezřívavosti vůči okolí, stavů neklidu či agresivity. K jejich rozvoji obvykle dochází zejména v pokročilejších stádiích nemoci a jsou i přímým důsledkem narušeného fungování mozkových center, která za náladu i chování zodpovídají. Období mírné kognitivní poruchypředstavuje stádium, kdy jsou již hmatatelné a současnými diagnostickými postupy prokazatelné první obtíže, člověk je přesto stále schopen v běžném dni samostatně fungovat. Stádia syndromu demence onemocnění dosáhne v okamžiku, kdy se člověk stane plně odkázaným na péči blízkých.
Historické souvislosti a vývoj vědeckého poznání
Syndrom demence je pouhou špičkou ledovce, kterému na úrovni mozkové tkáně předchází celá kaskáda patologických dějů. V roce 1907 Alois Alzheimer, německý psychiatr a neuropatolog, prvně předložil biologickou teorii záhadného duševního onemocnění, u něhož se tehdy předpokládala příčina ryze psychologická. V mozkové tkáni své pacientky Augusty D., která před smrtí trpěla demencí, tehdy nalezl tzv. senilní plaky a do té doby neznámá klubka (tangles). K nevůli tehdejší odborné obce je dal do souvislosti s projevy onemocnění dnes světoznámé Augusty D. V témže roce publikoval totožný objev také Oskar Fischer, český psychiatr a neuropatolog, ovšem dokonce u 16 pacientů se syndromem demence. Vlivem společenských okolností tehdejší doby, jeho jméno ale světoznámého rozsahu nedosáhlo.
Od počátku 20. století bylo věnováno mnoho lidského úsilí i finančních zdrojů ve snaze rozšířit toto poznání s jasným cílem – nalézt lék, který Alzheimerovu nemoc vyléčí. Nutnou podmínkou k tomu však je poznat toto onemocnění do hloubky, teprve tehdy je možné léčebné molekuly cílit tím správným směrem. Dnes víme, že Alzheimerova nemoc je téměř celoživotní onemocnění, které člověk ale sám typicky zaznamená až na počátku stáří (typicky po 65. roce života). Udává se, že první patologické změny na úrovni samotných molekul se odehrávají asi 15-20 let před tím, než člověk nebo jeho nejbližší okolí zaznamená jakékoliv obtíže. Díky rozvoji moderních technologií jsme schopni také takto brzy tyto změny v mozku nemocného identifikovat. Pokrok v oblasti diagnostiky však mílovými kroky předčil oblast vývoje léků. To je i důvodem, proč tyto moderní – poměrně invazivní a finančně nákladné – technologie prozatím nejsou součástí standardního diagnostického procesu. K čemu tedy tak časné poznání nemoci může být dobré? Mnoho nadějných léků selhalo. Ale i selhání přineslo mnohá ponaučení. Jedním z nich bylo, že možná nebyla chyba v samotném léku, ale v tom, komu byl lék podáván. Zpětné hodnocení některých klinických studií přineslo zjištění, že až polovina pacientů zařazených do studie, Alzheimerovou nemocí vůbec netrpělo. A možná proto lék selhal. A možná proto máme nyní více naděje, že díky novým technologiím, které umožňují velice časně rozpoznat ty „správné“ osoby, nějaký lék konečně uspěje.
Současné možnosti diagnostiky a terapie
Jaké jsou možnosti v současné léčbě? Lék, který by nemoc zcela zastavil (tzv. kauzální léčba), neexistuje. V současnosti existuje tzv. symptomatická léčba, jejímž cílem je postup onemocnění zpomalit a oddálit tak konečné stádium demence, kdy člověk ztrácí soběstačnost. Pomáhá ovlivnit konkrétní příznaky nemoci a zmírnit tím dopad nemoci na kvalitu života nemocného i jeho blízkých pečujících. Z těchto důvodů je nejlepší nasadit pacientovi léky včas, tedy ve chvíli, kdy mozek ještě není nemocí příliš poškozen, ale jsou již přítomny výraznější obtíže. Vyhledat lékaře se vyplatí ve chvíli, kdy u sebe člověk pozoruje obtíže, o to spíše, pokud si jich všímá i někdo z blízkých a obtíže mají tendenci se v čase postupně zhoršovat. Cílem diagnostického procesu je odlišit obtíže, které jsou běžnou součástí procesu přirozeného stárnutí, od obtíží, které jsou výraznější a pravděpodobně tedy důsledkem nemoci. Nelze předpokládat, že se to podaří rozklíčovat v průběhu jedné návštěvy lékaře. Důležitou součástí je přinejmenším podrobná analýza obtíží nemocného, kvůli kterým přichází, důkladné neurologické vyšetření, zobrazení mozku a neuropsychologické vyšetření, které obvykle trvá přibližně dvě hodiny.
Možnosti prevence – celoživotně a typicky ve stáří
Klíčovou roli v prevenci, nástupu i průběhu onemocnění Alzheimerovou nemocí hrají ale i nefarmakologické terapeutické přístupy. Faktory jako fyzická aktivita, stravování nebo meditace dokáží kolikrát více než bychom čekali. Mnohé studie zjistily, že pravidelná aerobní aktivita (tedy aktivita, při které máme tepovou frekvenci přibližně 110-120 tepů za minutu) dokáže významně snížit riziko nástupu Alzheimerovy nemoci. Starší lidé bez fyzické aktivity měli dvakrát vyšší riziko rozvoje demence než ti s pravidelnou fyzickou aktivitou. Také se ukazuje, že aktivnější jedinci mají lepší paměť a pomaleji u nich dochází k úbytku mozkové tkáně. Cvičení zvyšuje prokrvení mozku a chrání cévy před ukládání tuků do jejich stěn. Tím chrání mozek a jeho funkce před poškozením. Dalším významným faktorem pro zdraví mozku je vyvážené a na vitamíny bohaté stravování. Takový jídelníček by měl obsahovat pravidelný přísun čerstvé ovoce a zeleniny, na mastné kyseliny bohatou stravu (přírodní oleje, ořechy, klíčky, čerstvé ryby), dostatečný příjem luštěnin a léčivého koření (např. kurkuma). Naopak bychom se ve svém jídelníčku měli vyvarovat jednoduchým cukrům, konzervantům, umělým sladidlům a dochucovadlům, ztuženým tukům a nadměrné konzumaci alkoholu. AIdeálním příkladem stravování je tzv. středomořská dieta. V neposlední řadě bychom neměli zapomenou zmínit péči o duševní zdraví, ať už formou meditace nebo spirituality. Pro duševní zdraví je také důležité pěstování a udržování dobrých sociálních vztahů s přáteli i rodinou. Dlouhodobý pocit osamělosti ve stáří zvyšuje riziko srdečních onemocnění, riziko cévní mozkové příhody a je spojován s častějším výskytem Alzheimerovy nemoci.
Shrnující informační okénko – důležitá čísla a pojmy:
- • Alzheimerova nemoc, alternativně Alzheimerova-Fischerova nemoc;
- • 1907: rok, kdy byla Aloisem Alzheimerem a nezávisle na něm také Oskarem Fischerem prvně doložena biologická podstata dosud záhadného duševního onemocnění;
- • 60 %: procento případů syndromu demence, za které zodpovídá Alzheimerova nemoc;
- • mírná kognitivní porucha: stádium onemocnění, ve kterém již člověk má znatelné obtíže s kognicí (např. pamětí), ale je schopný v běžném dni samostatně fungovat. Někdy je označována jako mezistupeň mezi zdravým stárnutím a stádiem demence;
- • demence: soubor příznaků zahrnující narušení kognitivních funkcí, změny v chování a ztrátu soběstačnosti v činnostech běžného dne; vždy je projevem onemocnění mozku;
- • stařecká demence: termín, který je pozůstatkem z dřívější doby a dnes již nemá být používán; za současného stavu poznání již víme, že demence není nevyhnutelným projevem stárnutí, vždycky je projevem určitého onemocnění;
- •neurodegenerativní onemocnění: způsobující postupné odumírání (-degenerace) mozkové tkáně (neuro-);
- • hipokampus: mozková struktura klíčová pro vytvoření nových vzpomínek a souvislostí mezi nimi, jeho funkce bývá Alzheimerovou nemocí zasažena jako první;
- • beta amyloid a tau: proteiny; ukládání jejich patologických forem v mozkové tkáni stojí – dle současného poznání – na počátku Alzheimerovy nemoci, mnoho let před rozvojem prvních příznaků.
Reference
- Alzheimer’s Disease International. (2019). World Alzheimer Report. London.
- Alzheimer’s Disease International. (2018). World Alzheimer Report 2018. London.
- Čechová, K., Fendrych Mazancová A., Marková H. (Eds.) et al. (2019). V bludišti jménem Alzheimer: Na co v ordinaci nezbývá čas. Prague: Albatros Media.
Mitofagie a její role při stárnutí a neurodegeneraci
Invited article for BestPractice
Ruben Gudmundsrud
Molecular biology and biochemistry programme, University of Oslo
Hilde Nilsen
Department of Clinical Molecular Biology, University of Oslo and Akershus University Hospital, 1478 Lørenskog, Norway
Vilhelm A. Bohr
Laboratory of Molecular Gerontology, National Institute on Aging, National Institutes of Health, Baltimore, MD 21224
Danish Center for Healthy Aging, University of Copenhagen, Blegdamsvej 3B, 2200 Copenhagen, Denmark
Evandro F. Fang
Department of Clinical Molecular Biology, University of Oslo and Akershus University Hospital, 1478 Lørenskog, Norway
Korespondující autor
Evandro F. Fang (e.f.fang@medisin.uio.no)
Úvod: hrozivý tlak stárnutí a neurodegenerace související s věkem
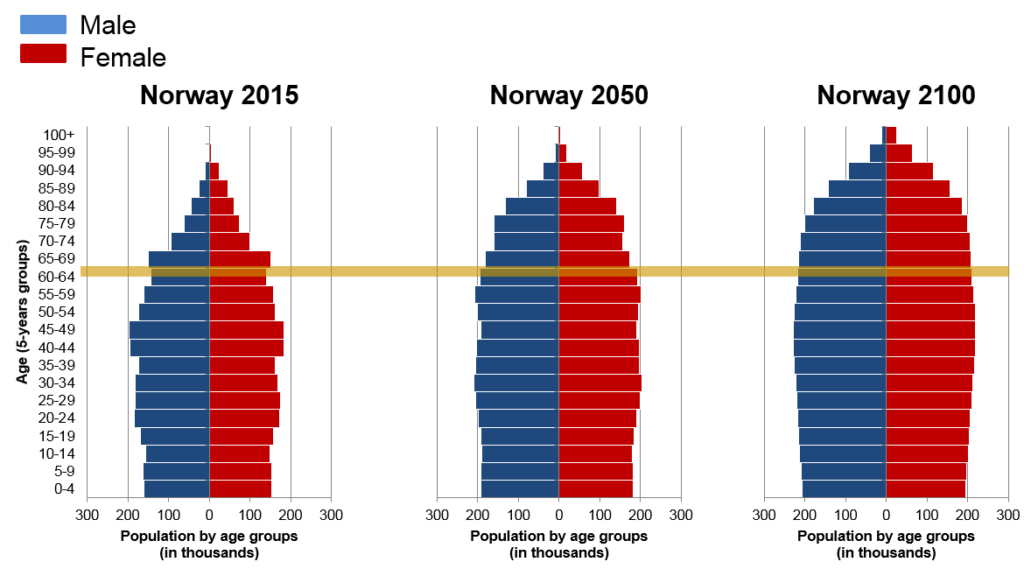
Lidé na celém světě žijí déle. To vytváří tlak na obrovské výzvy v oblasti zdravotní péče, které jsou způsobeny stárnutím. V Norsku bylo v roce 2016 16,6 % starších osob (65+) a do roku 2050 a 2100 se jejich počet dramaticky zvýší (obr. 1). Stárnutí je hlavní příčinou téměř všech negenetických lidských onemocnění, včetně neurodegenerace. Alzheimerovou nemocí (AN) jako nejčastější formou syndromu demence trpí 44,5 milionu lidí na světě, přičemž se očekává, že do roku 2050 (1) se jejich počet ztrojnásobí. Tato situace představuje velké socioekonomické problémy, včetně výdajů na geriatrickou péči, velké zátěže pro rodinu a devastující narušení kvality života postižených osob (1). Lék na AN neexistuje. Další pochopení jejích složitých molekulárních mechanismů bude hnacím motorem pro objevování nových léků s širokým ekonomickým dopadem.
Co je to porucha mitofagie a jak souvisí se stárnutím a neurodegenerací?
Mitochondrie jsou “elektrárny buňky”. Hrají zásadní roli v životě a zdraví, včetně energetického metabolismu, hlavních buněčných signálních drah, vzájemných vazeb mezi mitochondriemi a jádrem, při vývoji neuronů a dokonce i v určování osudu buňky (smrti nebo přežití) (2). Lidské zdraví tak může být přímo ovlivněno kvalitou mitochondrií, která je regulována několika buněčnými drahami, především drahou mitochondriální autofagie.
Autofagie je buněčný proces degradace a další recyklace poškozených organel nebo makromolekul. Existují různé formy autofagie, například makroautofagie, která je nespecifická a běžně se používá k produkci energie během hladovění nebo cvičení. Mitofagie je degradace mitochondrií neboli selektivní autofagie mitochondrií (1,3). Proces autofagie lze nastínit zhruba takto: Autofagozom (v případě mitofagie mitofagozom) je zapouzdřen do organely uzavřené dvojitou membránou, která je následně degradována v procesu fúze s lysozomem za vzniku autolysozomu (nebo v případě mitofagie mitolysozomu) (1,2). Mitofagie je často iniciována poškozenými mitochondriemi, které představují pro buňky hrozbu. Z poškozených mitochondrií unikají ionty, volné elektrony a produkují méně energie. Elektrony tvoří reaktivní formy kyslíku (ROS), které způsobují oxidační stres. Hromadění nefunkčních mitochondrií se podílí na neurodegeneraci (1, 2, 4).
Defektní mitofagie u Alzheimerovy nemoci (AN) může přispívat k hromadění poškozených mitochondrií, které se dále podílí na tvorbě Aβ plaků a Tau klubek (dva charakteristické znaky AN) a nakonec vedou k zhoršování AN. Za prvé, mitochondriální dysfunkce je prokázána jak u sporadické tak dědičné formy AN (5). Za druhé, narušená mitofagie byla prokázána u neuronů odvozených ze zvířecích modelů AN (1). Za třetí, akumulace poškozených mitochondrií může indukovat formování Aβ plaků a tau tangles a naopak (1). Např. narušená mitofagie vytváří buněčný stres, což urychluje tvorbu Aβ plaků, což může být důsledek mitochondriálního oxidačního stresu, který zvyšuje produkci Aβ modifikací g-sekretázy (enzymový komplex, který štěpí část APP za vzniku Aβ) (6). Zdá se, že naopak samotná alzheimerovská patologie způsobuje další zhoršení mitofagie. Vzniká tak začarovaný kruh, kdy poškozené mitochondrie způsobují AN, která opět poškozuje další mitochondrie (1).
Během života se v našem těla hromadí poškozená DNA. Toto poškození aktivuje reparační systémy DNA. Jedním ze zapojených proteinů je poly(ADP-ribóza) polymeráza 1 (PARP1), která je zapojena do několika cest DNA reparace. Tento mechanismus využívá kofaktor nikotinamidadenindinukleotid (NAD+), což je také případ části jedné z mnoha cest indukujících mitofagii (2). Proteiny rodiny sirtuinů (SIRT) jsou NAD+-dependentní deacetylázy, které se podílejí na řadě procesů, pravděpodobně také na aktivaci mechanismu mitofagie prostřednictvím signálních drah (2). Při nárůstu poškození DNA (stárnutí, nemoci zrychleného stárnutí) spotřebovávají DNA reparační systémy (zejména PARP1) značnou část poolu NAD+, což opět snižuje aktivitu SIRT1 a pozorujeme méně mitofagie (2). Zdá se, že toto vyčerpání NAD+ je při stárnutí univerzální (1).
Intervenční strategie k regulaci mitofagie
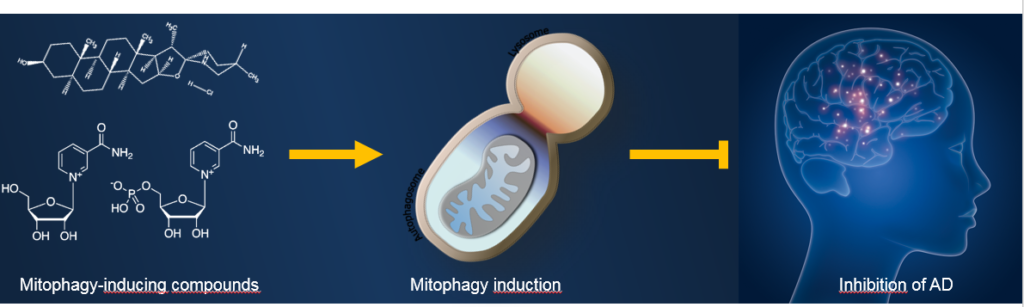
Zvýšení aktivity mitofagie za účelem udržení zdravého mitochondriálního fondu se stává novou terapeutickou strategií v léčbě AN (viz obrázek 1). Např. zvýšení autofagie (včetně mitofagie) prostřednictvím inhibitoru rapamycinu (mTOR; z angl. mammalian target of rapamycin) zmírnila kognitivní deficit u myší a snížila množství amyloidových plak (7). Podávání prekurzoru NAD+, nikotinamid ribosidu (NR), trangenním myšším- modelem Alzheimerovy nemoci- snížilo množství patologického tau proteinu v mozku (8). Genetická aktivace mitofagie vedla k inhibici AN patologie u daných myších modelů (9). Bylo by zajímavé otestovat efekt i dalších známých induktorů mitofagie na myšších modelech AN, jako je tomatidin (přírodní sloučenina ze zelených rajčat).
Zbývající otázky a klinické využití
Z hlediska translační perspektivy, autoři nyní postupují od laboratorních ke klinickým zkouškám prekurzorů NAD+ u AN a dalších věkově vázaných onemocněních jako například syndrom předčasného stárnutí a další neurodegenerativní onemocnění. Probíhá několik klinických studií s prekurzory NAD+. Jedním z cílů těchto zkoušek je zjistit správné dávkování prekurzorů NAD+ a případné vedlejší účinky (1). Zbývá objasnit otázky, například jak poškození DNA ovlivňuje mitofagii a proč je mitofagie u AN narušena? Mají nicotinamide riboside a další prekurzor NAD+, nikotinamid mononukleotid, stejné klinické účinky?
Závěr
Stárnutí a neurodegenerace představují společně socioekonomické výzvy. Nové výzkumy poukazují na dysfunkční mitochondrie jak při stárnutí, tak při neurodegeneraci a zdá se, že klíčovým problémem by mohlo být poškození mitofagie. Nové látky vyvolávající mitofagii ukazují slibný potenciál v zabránění či zpomalení procesu neurodegenerace. Probíhá několik klinických studií, jejichž cílem je ověřit, zda by se prekurzor NAD+ NR mohl stát účinným profylaktickým doplňkem. Zajímavý potenciál vykazuje také tomatidin. Pokud se podaří oddálit či zpomalit AN a další neurodegenerativní onemocnění, dospějeme ke zdravému stárnutí společnosti.
Reference
1. Kerr, J.S. et al. Mitophagy and Alzheimer’s Disease: Cellular and Molecular Mechanisms. Trends Neurosci 40, 151-166 (2017).
2. Fang, E.F. et al. Nuclear DNA damage signalling to mitochondria in ageing. Nat Rev Mol Cell Biol 17, 308-321 (2016).
3. Palikaras, K., Lionaki, E. & Tavernarakis, N. Coordination of mitophagy and mitochondrial biogenesis during ageing in C. elegans. Nature 521, 525-528 (2015).
4. Fivenson, E.M. et al. Mitophagy in neurodegeneration and aging. Neurochem Int 109, 202-209 (2017).
5. Swerdlow, R.H., Burns, J.M. & Khan, S.M. The Alzheimer’s disease mitochondrial cascade hypothesis: progress and perspectives. Biochim Biophys Acta 1842, 1219-1231 (2014).
6. Gwon, A.R. et al. Oxidative lipid modification of nicastrin enhances amyloidogenic γ‐secretase activity in Alzheimer’s disease. Aging Cell 11, 559-568 (2012).
7. Spilman, P. et al. Inhibition of mTOR by Rapamycin Abolishes Cognitive Deficits and Reduces Amyloid-β Levels in a Mouse Model of Alzheimer’s Disease. PLOS ONE 5, e9979 (2010).
8. Hou, Y. et al. NAD(+) supplementation normalizes key Alzheimer’s features and DNA damage responses in a new AD mouse model with introduced DNA repair deficiency. Proc Natl Acad Sci U S A 115, E1876-E1885 (2018). 9. Du, F. et al. PINK1 signalling rescues amyloid pathology and mitochondrial dysfunction in Alzheimer’s disease. Brain 140, 3233-3251 (2017).



